Introducción
La enfermedad hepática por depósito de grasa asociada a disfunción metabólica (MASLD) representa la evolución conceptual de la antigua NAFLD/MAFLD. Se caracteriza por la coexistencia de esteatosis hepática y al menos un rasgo del síndrome metabólico, en ausencia de consumo significativo de alcohol y otras causas secundarias. Su importancia radica en que no es solo una enfermedad hepática: es un trastorno multisistémico con impacto directo en la salud cardiovascular, renal y metabólica.
Desde 1980, con la descripción inicial de NASH, la comprensión del rol de la disfunción metabólica en la progresión hacia cirrosis, carcinoma hepatocelular y complicaciones extrahepáticas ha transformado el enfoque clínico y terapéutico.
Carga Global
- MASLD es hoy la enfermedad hepática crónica más frecuente, con una prevalencia mundial de hasta 38% en adultos.
- En pacientes con diabetes tipo 2, la prevalencia global es 65% y la de MASH alcanza 32%.
- Según el Global Burden of Disease 2021, entre 1990 y 2021 la carga de enfermedad (DALYs) casi se duplicó, pasando de 1.69 millones a 3.67 millones, con mayor impacto en países de nivel socioeconómico intermedio. Los mayores incrementos se observaron en China e India.
- El riesgo de progresión incluye:
- Hepatocarcinoma: incidencia de 1.25/1000 persona-año, que aumenta a 20/1000 en cirrosis MASLD.
- Complicaciones extrahepáticas: incremento del riesgo de diabetes tipo 2 (×2.2), enfermedad cardiovascular fatal y no fatal (×1.5–2.5), insuficiencia cardíaca, fibrilación auricular, enfermedad renal crónica y ciertos cánceres extrahepáticos (riesgo ×1.2–1.5).
- La principal causa de muerte en estos pacientes es la enfermedad cardiovascular.
Historia natural de MASLD
Factores determinantes
- Adiposidad visceral, resistencia a la insulina y número de anormalidades metabólicas son los principales motores de progresión.
- Diabetes tipo 2 es el factor más fuerte, seguido de obesidad e hipertensión.
- Otros moduladores: hipotiroidismo primario (riesgo ↑), estrógenos (protección), dieta (fructosa y alcohol ↑, dieta mediterránea ↓), genética (PNPLA3, TM6SF2, APOB), epigenética y microbiota.
Etapas de evolución
- Hígado normal → Esteatosis aislada
- Acúmulo de grasa hepática sin inflamación.
- Afecta 65–85% de personas en riesgo.
- MASLD con disfunción metabólica
- Concomitancia de esteatosis y ≥1 rasgo del síndrome metabólico.
- MASH (esteatohepatitis metabólica)
- En ~30% de pacientes con MASLD.
- Lipotoxicidad → daño hepatocelular e inflamación lobulillar.
- Es el principal impulsor de fibrosis progresiva.
- Fibrosis hepática progresiva
- Escala histológica F0–F4:
- F0: sin fibrosis
- F1: perisinusoidal/portal
- F2: perisinusoidal + periportal
- F3: fibrosis en puentes/septal
- F4: cirrosis
- Fibrosis ≥F2 = predictor fuerte de mortalidad y complicaciones.
- Escala histológica F0–F4:
- Cirrrosis y descompensación hepática
- Ascitis, encefalopatía, hipertensión portal.
- Riesgo de hepatocarcinoma (HCC) entre 0.5–2.5% por año.
Tiempos aproximados de progresión
- De F0/F1 a cirrosis: 30–35 años.
- De F2 a cirrosis: ~19–20 años.
- De F3 a cirrosis: ~5–6 años.

Identificación de pacientes con MASH de riesgo
1. Enfoque recomendado por sociedades de hepatología
- Búsqueda inicial en atención primaria y especialistas en enfermedades metabólicas o hepáticas.
- Poblaciones a tamizar:
- Personas con diabetes tipo 2.
- Pacientes con múltiples factores de riesgo metabólico.
- MASLD con elevación persistente de enzimas hepáticas.
2. Algoritmo secuencial de estratificación
- FIB-4 (Fibrosis-4 index) como prueba inicial:
- <1.30 (<2.0 en mayores de 65 años): bajo riesgo → seguimiento con reevaluación cada 1–3 años.
- 1.30–2.67: riesgo intermedio → pruebas adicionales.
- >2.67: alto riesgo → derivación a hepatología.
- Segunda línea en riesgo intermedio o alto
- Elastografía transitoria (VCTE, corte ≥8 kPa).
- ELF (Enhanced Liver Fibrosis, corte ≥10.5).
- Elastografía por RMN (≥3.1 kPa).
- Biopsia hepática si resultados discordantes o dudas diagnósticas.
3. Factores que aumentan la probabilidad de MASH de riesgo
- Diabetes tipo 2 (principal factor).
- ≥2–3 rasgos del síndrome metabólico.
- Obesidad central marcada.
- Hipotiroidismo primario.
- Elevación persistente de ALT/AST.
- Presencia de polimorfismos de riesgo (ej. PNPLA3).
Se muestran los criterios para establecer el diagnóstico de enfermedad hepática esteatósica asociada a disfunción metabólica (MASLD) en adultos, así como su progresión hacia esteatohepatitis asociada a disfunción metabólica (MASH).
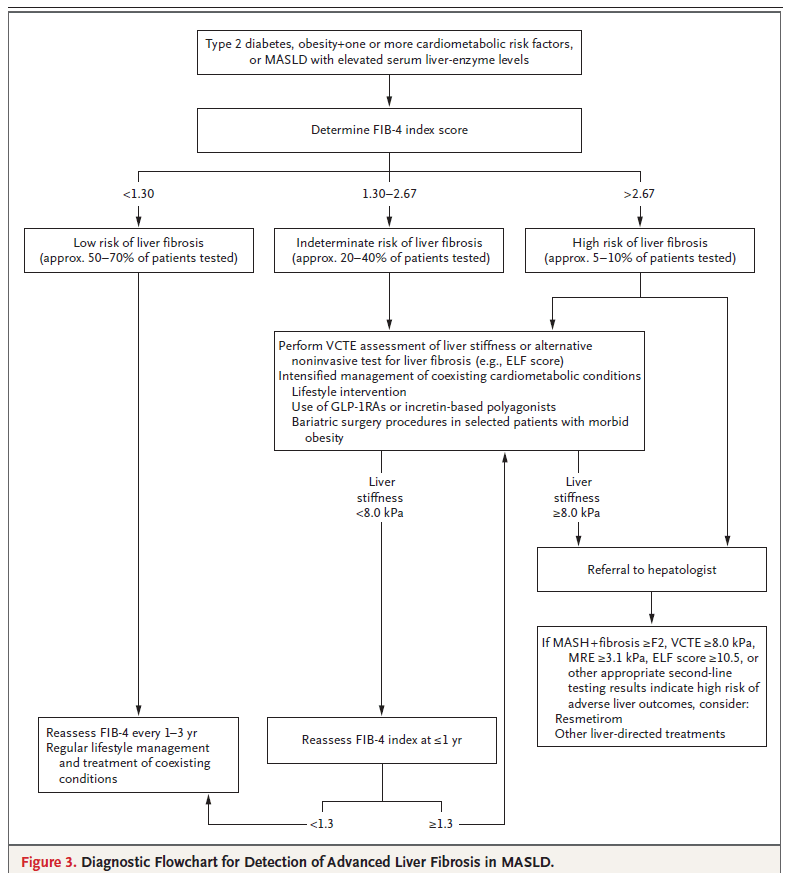
4. Recomendaciones de manejo en esta población
- Control intensivo de diabetes, obesidad e HTA.
- Estrategias de pérdida de peso (dieta, ejercicio, GLP-1RAs, cirugía bariátrica en casos seleccionados).
- En pacientes confirmados con MASH + fibrosis ≥F2: considerar resmetirom u otros fármacos dirigidos al hígado, según disponibilidad.
Farmacoterapia para MASLD
Base del tratamiento
- Pérdida de peso sostenida:
- ≥5% → mejora esteatosis.
- 7–10% → mejora inflamación.
- ≥10% → mejora fibrosis.
- Estrategias: dieta hipocalórica, ejercicio, control de comorbilidades, cirugía bariátrica en casos seleccionados.
- Problema: adherencia baja a largo plazo.
1. Fármacos aprobados
- Resmetirom (2024, FDA, aprobación condicional)
- Agonista selectivo de receptor beta de hormona tiroidea.
- Indicación: adultos con MASH no cirrótico y fibrosis moderada-avanzada (F2–F3).
- Beneficios: resolución de MASH sin empeorar fibrosis y reducción ≥1 etapa de fibrosis.
- Efectos adicionales: ↓ LDL-C, triglicéridos, lipoproteína(a).
- Eventos adversos: náusea y diarrea, en general leves; requiere vigilancia endocrina (tiroides, gonadal, ósea).
2. Incretínicos y agonistas combinados
- Agonistas de GLP-1 (ej. semaglutida)
- Mejoran pérdida de peso, control glucémico y perfil lipídico.
- Evidencia: resolución de MASH en ≥60% de pacientes (ESSENCE trial, 2025) con mejoría también en fibrosis.
- Eventos adversos: gastrointestinales leves-moderados.
- Agonistas duales y triples
- Tirzepatida (GLP-1/GIP): ↑ resolución de MASH y reducción de fibrosis, con pérdida de peso ~15%.
- Survodutide (GLP-1/glucagón) y Retatrutide (GLP-1/GIP/glucagón): potentes en reducción de grasa hepática y peso.
- Principales efectos adversos: gastrointestinales, mayor tasa de discontinuación en dosis altas.
3. Otros agentes en investigación
- Lanifibranor (agonista pan-PPAR): mostró mejoría en inflamación y fibrosis, pero con ganancia de peso y edema.
- Otros en fases tempranas: moduladores de lípidos, agonistas FXR, fármacos antifibróticos específicos.
4. Perspectiva terapéutica
- Manejo integral: además del hígado, objetivo en complicaciones cardiometabólicas (EVC, DM2, ERC).
- En el futuro, combinación de agentes metabólicos + antifibróticos podría ser el estándar.
- El tratamiento debe personalizarse según:
- Nivel de fibrosis.
- Comorbilidades (DM2, obesidad, ECV).
- Tolerancia y acceso a fármacos.


Conclusiones
- MASLD es un trastorno hepático-metabólico multisistémico con alta prevalencia y consecuencias que trascienden el hígado.
- Su historia natural sigue un curso progresivo desde esteatosis simple hasta cirrosis/HCC, determinado por factores metabólicos, genéticos y ambientales.
- La estratificación de riesgo con FIB-4 y elastografía permite identificar a los pacientes candidatos a terapias dirigidas.
- La pérdida de peso sostenida sigue siendo la base del manejo.
- Resmetirom y los agonistas incretínicos representan un cambio de paradigma, con beneficios tanto hepáticos como cardiometabólicos.
- El futuro apunta a un manejo integral cardiorreno-metabólico, con terapias combinadas y personalizadas.

Suscríbete para seguir leyendo
Suscríbete para obtener acceso al contenido íntegro de esta entrada y demás contenido exclusivo para suscriptores.
