Un enfoque integrador, fisiopatológico y centrado en el paciente
Introducción
El síndrome metabólico (MetS) constituye uno de los mayores desafíos actuales para la práctica clínica y la salud pública. Se trata de un estado patológico complejo y progresivo, caracterizado por la agregación de obesidad abdominal, resistencia a la insulina, dislipidemia aterogénica, hipertensión arterial e hiperglucemia, que confiere un riesgo marcadamente elevado de enfermedad cardiovascular (ECV), diabetes mellitus tipo 2 (DM2), enfermedad renal crónica (ERC) y mortalidad prematura.
Más allá de la simple coexistencia de factores de riesgo, el MetS representa una entidad clínica con fisiopatología compartida, cuyo eje central es la adiposidad visceral y ectópica disfuncional, asociada a inflamación crónica de bajo grado, estrés oxidativo y alteraciones metabólicas multisistémicas. Su prevalencia creciente, impulsada por urbanización, sedentarismo, dietas hipercalóricas y determinantes sociales adversos, exige un abordaje integral, precoz y personalizado.
Evolución histórica y conceptual del síndrome metabólico
El concepto de MetS se origina en 1988 con la descripción del “síndrome X” por Gerald Reaven, quien postuló que la resistencia a la insulina constituía el nexo entre dislipidemia, hipertensión y riesgo cardiovascular, incluso en ausencia de diabetes manifiesta. Posteriormente, múltiples organismos propusieron definiciones operativas (OMS, EGIR, NCEP-ATP III, IDF, AHA/NHLBI), culminando en los criterios armonizados de 2009, ampliamente utilizados en la práctica clínica.
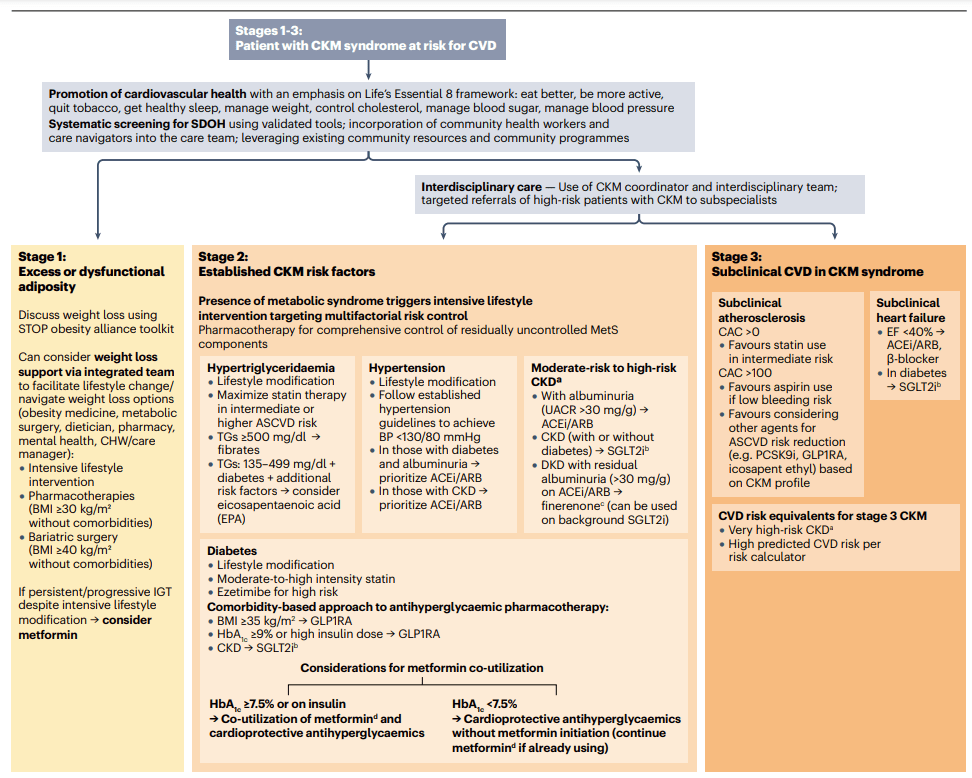
No obstante, el MetS ha sido objeto de controversia, especialmente por su uso como diagnóstico binario y no como un continuo de riesgo. En respuesta a estas limitaciones, en 2023 la American Heart Association propuso el concepto ampliado de síndrome cardiovascular–renal–metabólico (CKM), que integra la interacción dinámica entre obesidad disfuncional, MetS, DM2, ERC y ECV, resaltando el carácter multisistémico y progresivo del proceso patológico.
Epidemiología global: una epidemia silenciosa
La prevalencia global del MetS es alarmantemente alta y heterogénea:
- Estados Unidos: ~42% de los adultos, con incremento impulsado por hiperglucemia y obesidad abdominal.
- Canadá: ~42%, con fuerte influencia del nivel socioeconómico.
- América Latina: prevalencias elevadas, especialmente en mujeres (ej. México >44%).
- Europa: 20–30%, dependiendo de los criterios diagnósticos.
- Asia: rápido incremento, con riesgo elevado a menores valores de IMC y circunferencia abdominal.
- África: prevalencia ~30%, con desafíos adicionales por VIH y desigualdades estructurales.
Preocupa especialmente el aumento del MetS en niños y adolescentes, asociado a obesidad severa, sedentarismo, uso excesivo de pantallas y dietas ultraprocesadas, lo que anticipa una carga futura aún mayor de enfermedad cardiometabólica.
Fisiopatología: el rol central de la adiposidad visceral disfuncional
Tejido adiposo como órgano endocrino
El tejido adiposo no es un simple reservorio energético, sino un órgano endocrino activo. En condiciones de exceso calórico crónico, la expansión del tejido adiposo ocurre por:
- Hipertrofia adipocitaria (aumento del tamaño celular)
- Adipogénesis insuficiente (limitada formación de nuevos adipocitos)
La incapacidad de expandir adecuadamente el tejido adiposo subcutáneo favorece la acumulación de grasa visceral (VAT) y grasa ectópica (hígado, músculo, páncreas, corazón, riñón), un sello distintivo del MetS.
Grasa ectópica y disfunción multiorgánica
La acumulación ectópica de lípidos se asocia a:
- Hígado: MASLD (antes NAFLD), aumento de gluconeogénesis y VLDL.
- Músculo: resistencia a la insulina y menor producción de ATP.
- Páncreas: disfunción de células β.
- Corazón: grasa epicárdica, disfunción diastólica y arritmias.
- Riñón: hipertensión, activación del SRAA y progresión a ERC.
El riesgo cardiometabólico se correlaciona más con la calidad y distribución de la grasa que con el IMC total, explicando por qué individuos con IMC “normal” pueden presentar alto riesgo metabólico.
Resistencia a la insulina e inflamación crónica
La resistencia a la insulina (IR) es un pilar fisiopatológico del MetS. Se asocia a:
- Aumento de lipólisis y ácidos grasos libres.
- Activación del inflamasoma NLRP3.
- Secreción de adipocinas proinflamatorias (TNF, IL-6, MCP-1, PAI-1).
- Reducción de adiponectina (antiinflamatoria y sensibilizadora a la insulina).
Este estado inflamatorio crónico favorece:
- Disfunción endotelial
- Aterogénesis acelerada
- Estado protrombótico
- Daño cardiovascular y renal progresivo
Diagnóstico y estratificación: más allá de los criterios clásicos
El diagnóstico clínico del MetS se basa en la presencia de ≥3 de 5 criterios:
- Circunferencia abdominal aumentada (con puntos de corte específicos por sexo y etnia)
- Triglicéridos elevados
- HDL-C bajo
- Presión arterial elevada
- Glucosa en ayunas elevada
Sin embargo, el artículo enfatiza que el MetS debe entenderse como un continuo de riesgo, proponiendo un modelo de estadios (A–D) que integra:
- Factores de riesgo tempranos
- Componentes clásicos
- Marcadores de riesgo residual (ApoB, inflamación, microalbuminuria)
- Daño de órgano blanco
Este enfoque permite intervenciones graduadas según el estadio y el riesgo absoluto.
Prevención: intervenir temprano en el curso de la vida
La prevención del MetS debe comenzar antes de que se cumplan los criterios diagnósticos, enfocándose en:
- Actividad física regular
- Patrones dietéticos saludables (Mediterránea, DASH)
- Prevención de obesidad central
- Intervenciones en determinantes sociales de la salud
Incluso en presencia de MetS, la actividad física reduce significativamente el riesgo cardiovascular, subrayando su rol terapéutico fundamental.
Manejo clínico: un abordaje integral y escalonado
Estilo de vida como base terapéutica
- Pérdida de peso (5–10%) mejora significativamente los componentes del MetS.
- El objetivo prioritario es la reducción de adiposidad visceral, no solo del peso total.
Tratamiento farmacológico
Debe ser individualizado y dirigido a:
- Hipertensión (IECA/ARA II preferentemente)
- Dislipidemia (estatinas ± ezetimibe / PCSK9i según riesgo)
- Hiperglucemia (metformina, GLP-1 RA, SGLT2i con beneficio CV y renal)
Terapias antiobesidad
- Fármacos modernos (GLP-1 RA y agonistas duales) logran pérdidas de peso de 15–20%.
- Cirugía metabólica ofrece remisión de DM2, reducción de eventos CV y mortalidad en pacientes seleccionados.
Calidad de vida y consecuencias sistémicas
El MetS se asocia a:
- Depresión y ansiedad
- Trastornos del sueño (apnea obstructiva)
- Osteoartrosis
- Cánceres asociados a obesidad
- Reducción significativa de calidad de vida
Estas manifestaciones refuerzan la necesidad de un enfoque centrado en el paciente y multidisciplinario.
Perspectivas futuras
El artículo destaca varias áreas emergentes:
- Fenotipificación del MetS
- Uso de imágenes para cuantificar grasa visceral
- Inteligencia artificial para detección precoz
- Integración del concepto CKM en guías clínicas
- Políticas públicas orientadas a prevención poblacional
Conclusión
El síndrome metabólico es mucho más que la suma de factores de riesgo. Representa un estado patológico sistémico, progresivo y prevenible, cuyo eje es la adiposidad visceral disfuncional. La transición hacia el paradigma cardiovascular–renal–metabólico permite una comprensión más completa del riesgo y abre la puerta a intervenciones tempranas, personalizadas y efectivas.
Abordar el MetS de forma integral es esencial para revertir la epidemia de enfermedad cardiometabólica del siglo XXI.
Descubre más desde Medicina Cardiometabólica
Suscríbete y recibe las últimas entradas en tu correo electrónico.

