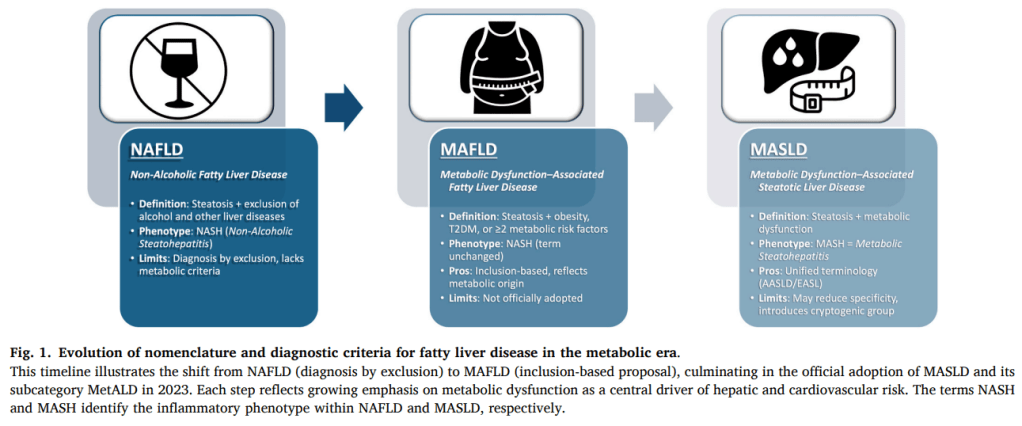
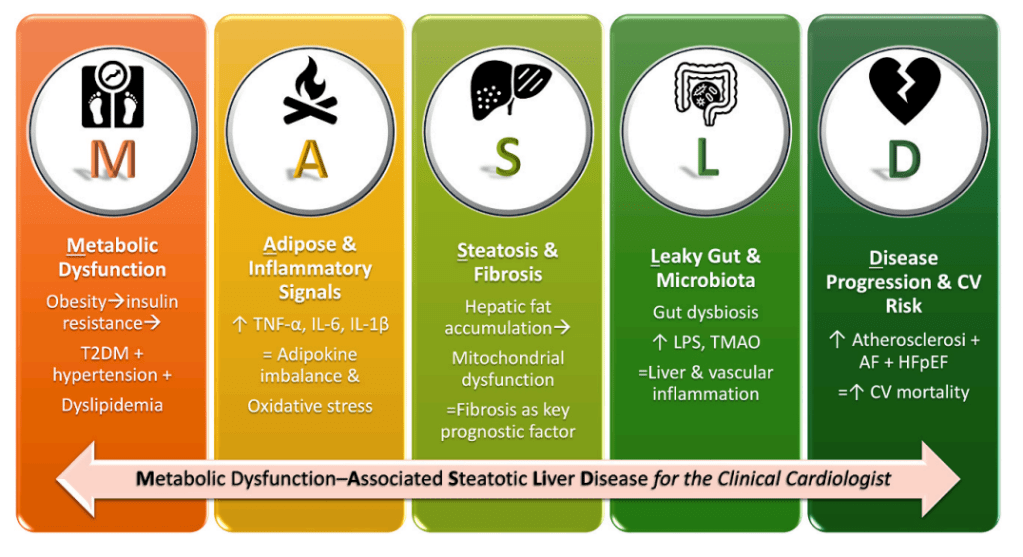
1. Redefinición de la enfermedad hepática grasa en la era metabólica
La transición de NAFLD → MAFLD → MASLD marca un cambio conceptual importante.
- NAFLD: diagnóstico de exclusión, dependía de descartar alcohol y otras causas, con problemas de estigmatización y falta de precisión fisiopatológica.
- MAFLD: propuso criterios de inclusión (esteatosis + obesidad, diabetes tipo 2 o disfunción metabólica), lo que permitió identificar pacientes antes “invisibles” (ej. delgados con resistencia a insulina).
- MASLD (2023): consensuada por AASLD y EASL como la nomenclatura oficial. Se acompaña de MASH, la forma inflamatoria y progresiva que predice cirrosis y hepatocarcinoma.
- Impacto en cardiología: reconoce la esteatosis hepática como marcador y mediador de riesgo cardiovascular, no un hallazgo incidental.
1.1. De la esteatosis a la aterosclerosis
- Inflamación crónica: TNF-α, IL-6, IL-1β promueven resistencia a la insulina, disfunción endotelial y activación de células estrelladas hepáticas.
- Estrés oxidativo: exceso de ácidos grasos libres → disfunción mitocondrial → ROS → daño endotelial y apoptosis hepatocitaria.
- Dislipidemia aterogénica: ↑ VLDL, LDL pequeñas/densas, ↓ HDL funcional → aceleración de aterosclerosis.
- Adipocinas: leptina y resistina aumentan inflamación; adiponectina baja pierde efecto protector.
- Eje intestino-hígado: permeabilidad intestinal aumentada permite entrada de LPS, activando TLR4 y perpetuando inflamación vascular y hepática.
1.2. Fibrosis como motor oculto del riesgo cardiovascular
- La fibrosis hepática avanzada predice mortalidad cardiovascular con más fuerza que la esteatosis aislada.
- Herramientas útiles en cardiología:
- FIB-4: edad, AST, ALT, plaquetas. Fácil, económico y validado.
- NFS: incluye IMC, glucosa y enzimas hepáticas.
- Elastografía: mide rigidez hepática, correlacionada con aterosclerosis subclínica (IMT carotídeo, calcio coronario).
- Evidencia: un FIB-4 ≥2.67 se asocia con ↑ mortalidad total (HR 1.64), cardiovascular (HR 2.96) y hepática (HR 10.5), independiente de otros factores de riesgo.
1.3. Interacciones hígado–corazón
- Evidencia epidemiológica:
- ↑ mortalidad CV (64 % en metaanálisis).
- ↑ riesgo de infarto, ACV, arritmias y muerte súbita.
- IC con fracción de eyección preservada (HFpEF):
- MASLD aumenta 2.6 veces el riesgo de IC, sobre todo HFpEF.
- Relación con grasa epicárdica, rigidez ventricular, inflamación sistémica.
- Fibrilación auricular (FA):
- HR 1.21 para incidencia de FA, especialmente en fibrosis avanzada.
- Mecanismos: inflamación, remodelado auricular, adiposidad epicárdica.
- Fibrosis hepática predice recurrencia tras ablación de FA.
- Implicación: se recomienda evaluar fibrosis hepática en pacientes con IC o FA inexplicada.
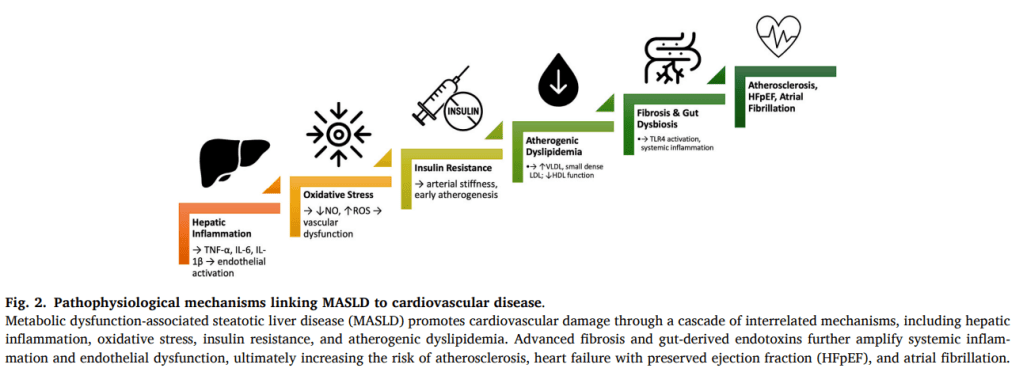
1.4. Disbiosis intestinal
- MASLD se acompaña de alteraciones microbianas:
- ↑ Enterobacteriaceae y Proteobacteria (proinflamatorias).
- ↓ Faecalibacterium prausnitzii y Akkermansia muciniphila (protectores).
- Consecuencias:
- ↑ permeabilidad intestinal → “leaky gut”.
- ↑ LPS y metabolitos tóxicos (ej. TMAO) → inflamación hepática y vascular.
- ↓ SCFAs → pérdida de efectos antiinflamatorios e insulin-sensibilizantes.
- Estrategias en estudio:
- Probióticos y prebióticos: mejoran esteatosis e inflamación.
- Dieta mediterránea y fibra: restauran diversidad microbiana.
- Trasplante fecal: en investigación, con resultados preliminares favorables.
1.5. Manejo de MASLD en el paciente cardiovascular
- Estilo de vida:
- Pérdida de peso del 3–10 % mejora esteatosis, inflamación y fibrosis.
- Dieta mediterránea → beneficios hepáticos y cardiovasculares.
- Ejercicio ≥300 min/semana → mejora sensibilidad a la insulina.
- Farmacoterapia:
- GLP-1RAs (liraglutida, semaglutida, tirzepatida): ↓ grasa hepática, inflamación y riesgo CV.
- SGLT2i (empagliflozina, dapagliflozina): ↓ mortalidad CV y grasa hepática.
- Pioglitazona: útil en MASH, limitada por ↑ peso y retención hídrica.
- Estatinas: seguras y subutilizadas, reducen fibrosis y riesgo CV.
- Nuevos fármacos:
- Resmetirom (THR-β agonista): aprobado para MASH con fibrosis moderada-avanzada.
- Lanifibranor (pan-PPAR): mejora fibrosis y perfil metabólico (fase 3 en curso).

2. Conclusiones
- MASLD es una enfermedad sistémica con fuerte impacto en riesgo cardiovascular.
- La fibrosis hepática debe integrarse en scores de riesgo CV (SCORE2, ASCVD).
- El abordaje debe ser multidisciplinario:
- Cardiología + hepatología + nefrología + endocrinología.
- Estilo de vida es el pilar, pero insuficiente en etapas avanzadas.
- Fármacos con beneficio dual (GLP-1RAs, SGLT2i, estatinas, pioglitazona) y nuevos agentes (resmetirom, lanifibranor) redefinirán el manejo.
Descubre más desde Medicina Cardiometabólica
Suscríbete y recibe las últimas entradas en tu correo electrónico.
